
自今年5月29日首次遞表港交所以來(lái),贛州和美藥業(yè)股份有限公司(簡(jiǎn)稱(chēng)“贛州和美藥業(yè)”)尚未通過(guò)聆訊。該公司申請(qǐng)?jiān)谙愀勐?lián)交所主板上市,擬募資用于旗下2個(gè)核心產(chǎn)品的研發(fā)和商業(yè)化及其他管線產(chǎn)品的研發(fā)。
招股書(shū)顯示,贛州和美藥業(yè)的經(jīng)營(yíng)歷史最早可追溯至2002年,其創(chuàng)始人張和勝創(chuàng)立了該公司的研發(fā)實(shí)體和美生物技術(shù),并于2009年開(kāi)始聚焦核心產(chǎn)品Mufemilast的臨床前研究。
贛州和美藥業(yè)針對(duì)自身免疫性疾病和腫瘤進(jìn)行小分子藥物開(kāi)發(fā),截至今年5月21日已擁有含7個(gè)小分子候選藥物的研發(fā)管線。其中,Mufemilast是該公司最早研發(fā)且研發(fā)進(jìn)展最快、開(kāi)發(fā)適應(yīng)證最多的核心產(chǎn)品。
招股書(shū)顯示,贛州和美藥業(yè)于2012年就Mufemilast提交臨床試驗(yàn)申請(qǐng),并在此后針對(duì)Mufemilast的8個(gè)適應(yīng)證開(kāi)展臨床試驗(yàn)。2024年3月,Mufemilast完成用于治療銀屑病(Ps)的國(guó)內(nèi)臨床Ⅲ期試驗(yàn)后,贛州和美藥業(yè)向國(guó)家藥監(jiān)局提交Mufemilast在銀屑病適應(yīng)證下的新藥上市申請(qǐng)(簡(jiǎn)稱(chēng)“NDA”)并獲優(yōu)先審評(píng)資格。
這意味著,在持續(xù)研發(fā)逾22年之后,贛州和美藥業(yè)或迎來(lái)其首個(gè)獲批產(chǎn)品。其累計(jì)耗時(shí)15年才完成Mufemilast的研發(fā),其中光臨床試驗(yàn)階段(2012—2024年)就占了13年。
不過(guò),即便尚未獲批上市,Mufemilast所面臨的競(jìng)爭(zhēng)環(huán)境已趨激烈。招股書(shū)顯示,我國(guó)已上市且已進(jìn)入醫(yī)保目錄的、用于治療銀屑病的小分子靶向藥共計(jì)有5個(gè),其中,安進(jìn)公司(AMGN.O)的apremilast(中文譯名:阿普司特/阿普米司特)與Mufemilast一樣靶向PDE4。此外,Mufemilast還有36個(gè)臨床階段的在研競(jìng)品,其中6個(gè)處于臨床Ⅲ期試驗(yàn)。
招股書(shū)未披露的是,2024年12月,上海陽(yáng)光醫(yī)藥采購(gòu)網(wǎng)公布的第十批全國(guó)藥品集采中選結(jié)果顯示,阿普米司特進(jìn)入該批次集采的仿制藥企業(yè)有8家。
6月16日、8月22日,就Mufemilast上市審批進(jìn)展、Mufemilast商業(yè)化進(jìn)展、研發(fā)資金可持續(xù)性等相關(guān)問(wèn)題,時(shí)代商業(yè)研究院向贛州和美藥業(yè)發(fā)郵件并嘗試致電詢問(wèn)。截至發(fā)稿,該公司尚未回復(fù)相關(guān)問(wèn)題。
成立至今逾22年尚未有產(chǎn)品獲批
作為一家生物制藥公司,贛州和美藥業(yè)致力于發(fā)現(xiàn)和開(kāi)發(fā)針對(duì)自身免疫性疾病和腫瘤的小分子藥物。招股書(shū)顯示,截至2025年5月21日,該公司已經(jīng)開(kāi)發(fā)出由7個(gè)候選藥物組成的在研產(chǎn)品管線。
從研發(fā)進(jìn)度看,贛州和美藥業(yè)的2個(gè)核心產(chǎn)品中,一個(gè)已提交NDA申請(qǐng)且尚未獲批上市,一個(gè)正在臨床Ⅲ期試驗(yàn);3個(gè)關(guān)鍵產(chǎn)品正在臨床Ⅰ、Ⅱ期試驗(yàn)中;另有2個(gè)在研產(chǎn)品尚處于臨床前研究。
不過(guò),贛州和美藥業(yè)的經(jīng)營(yíng)歷史最早可追溯至2002年。是年,該公司創(chuàng)始人張和勝成立了研發(fā)實(shí)體——和美生物技術(shù),開(kāi)啟了贛州和美藥業(yè)的創(chuàng)新藥研發(fā)之路。
2009年,贛州和美藥業(yè)開(kāi)始第一個(gè)研發(fā)產(chǎn)品Mufemilast的臨床前研究,并于2012年就Mufemilast提交臨床試驗(yàn)(IND)批準(zhǔn)申請(qǐng),并于2015年后就Mufemilast治療銀屑病(Ps)、白塞病(BD)、強(qiáng)直性脊柱炎(AS)等8種自身免疫性適應(yīng)證開(kāi)展臨床試驗(yàn)。
2024年,贛州和美藥業(yè)完成Mufemilast用于治療銀屑病的臨床Ⅲ期試驗(yàn)后,向國(guó)家藥監(jiān)局遞交了NDA申請(qǐng)并獲得優(yōu)先審批資格。這意味著,作為該公司最早研發(fā)且研發(fā)投入最大的核心產(chǎn)品,Mufemilast或是該公司研發(fā)進(jìn)展最快、有望實(shí)現(xiàn)首個(gè)獲批上市的產(chǎn)品。
自2002年至今,專(zhuān)注于新藥研發(fā)逾22年之久,Mufemilast若能實(shí)現(xiàn)首個(gè)獲批上市,無(wú)疑意味著贛州和美藥業(yè)的經(jīng)營(yíng)發(fā)展邁入了新的階段。要知道,從2012年提交臨床試驗(yàn)申請(qǐng)到2024年提交NDA申請(qǐng),Mufemilast光臨床試驗(yàn)階段就耗費(fèi)了12年之久。
由于無(wú)上市產(chǎn)品,自成立至今,贛州和美藥業(yè)主要以融資支撐其研發(fā)活動(dòng)。招股書(shū)顯示,僅2021—2024年,該公司就完成了6輪融資,累計(jì)獲得3258.62萬(wàn)美元和人民幣10.49億元,若按1美元兌7.18元人民幣折算,該公司累計(jì)融資12.83億元。
招股書(shū)還顯示,贛州和美藥業(yè)于2024年12月最新完成E輪融資所對(duì)應(yīng)的投后估值為39億元,較該公司2021年11月A輪融資的投后估值2億元,增長(zhǎng)18.5倍。
2023—2024年,贛州和美藥業(yè)分別虧損1.56億元、1.23億元,截至2024年末該公司累計(jì)虧損7.07億元。
核心產(chǎn)品未上市已面臨紅海競(jìng)爭(zhēng)
作為有望首個(gè)獲批上市的核心產(chǎn)品,Mufemilast的商業(yè)化前景仍存在諸多挑戰(zhàn)。
招股書(shū)顯示,Mufemilast是一種新型小分子磷酸二酯酶4B(PDE4B)蛋白表達(dá)阻斷劑和磷酸二酯酶4(PDE4)抑制劑,具有廣泛的自身免疫性疾病治療潛力。據(jù)弗若斯特沙利文的報(bào)告,因?yàn)镸ufemilast可以同時(shí)阻斷PDE4B蛋白的表達(dá),亦可抑制PDE4的活性,Mufemilast可能是一種具有雙重作用機(jī)制的全球同類(lèi)首創(chuàng)藥物,也是唯一可直接用于有潛伏性結(jié)核感染的銀屑病患者的藥物。
但是上述理論治療價(jià)值能否在臨床治療上得到驗(yàn)證,并進(jìn)一步獲得醫(yī)生和患者的廣泛接受,仍有待觀察。
招股書(shū)則顯示,截至2025年5月21日,我國(guó)已上市且已進(jìn)入醫(yī)保目錄的、用于治療銀屑病的小分子靶向藥共計(jì)有5種,其中安進(jìn)公司生產(chǎn)的apremilast(中文譯名:阿普司特/阿普米司特)跟Mufemilast一樣靶向PDE4。作為原研藥,安進(jìn)公司的阿普米司特已于2021年進(jìn)入國(guó)家醫(yī)保目錄。
此外,阿普米司特在國(guó)內(nèi)已有多家仿制藥生產(chǎn)企業(yè),且已于2024年被納入國(guó)家第十批藥品集采。
2024年12月,上海陽(yáng)光醫(yī)藥采購(gòu)網(wǎng)公布的第十批全國(guó)藥品集采中選結(jié)果顯示,有8家生產(chǎn)阿普米司特仿制藥的制藥企業(yè)在本次集采中中標(biāo)。
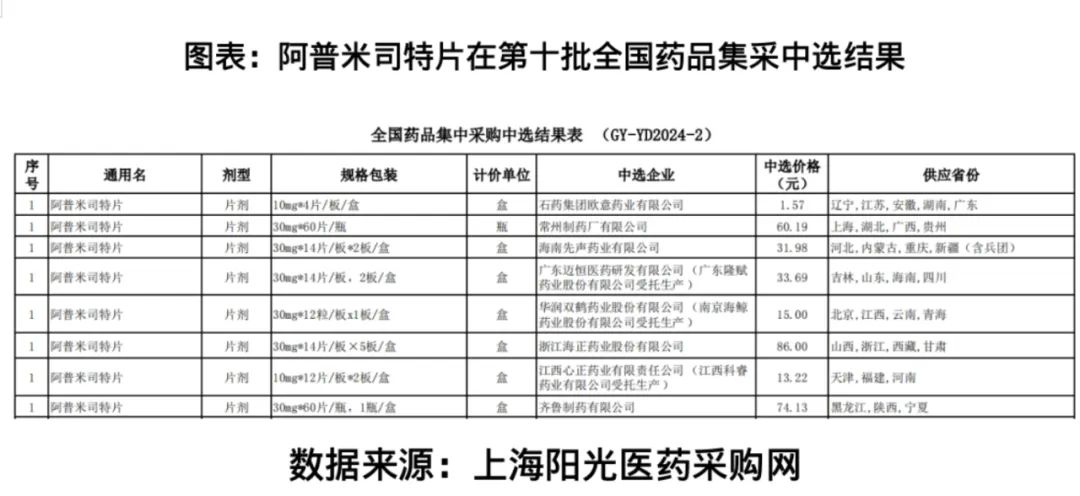
招股書(shū)還顯示,除了已上市競(jìng)品,Mufemilast亦面臨多個(gè)在研競(jìng)品。截至2025年5月21日,我國(guó)用于治療銀屑病的小分子靶向藥在研管線藥物中,進(jìn)入臨床階段的共計(jì)有36個(gè),其中6個(gè)處于臨床Ⅲ期試驗(yàn)階段。(時(shí)代商業(yè)研究院 雷小艷)

 京公網(wǎng)安備 11010802028547號(hào)
京公網(wǎng)安備 11010802028547號(hào)